| |
Zuerst muß man das Protein in geeigneter Form und Menge herstellen: |
| |
|
|
 |
| Zunächst wird mit der Polymerase-Kettenreaktion (PCR) die DNA mit der genetischen Information für das gewünschte Protein vermehrt |
 |
|
|
|
|
| Ein geeigneter Bakterienstamm wird transformiert, d.h., er nimmt die genetische Information für das gewünschte Protein in sich auf und kann dieses Protein nun "auf Kommando" selbständig herstellen. |
| |
|
 |
| Die Bakterien vermehren sich zunächst in ca. 1-2L Nährlösung (unter kräftigem Schütteln zur besseren Belüftung) und produzieren dann das gewünschte Protein in "größerer Menge" (10-100mg) |
| |
 |
|
Verwendet man Nährmedien mit einer "unnatürlichen" Isotpenzusammensetzung, dann produzieren die Bakterien auch entsprechendes Protein. So kann man z.B. Proteine mit über 95% des für NMRÂ wichtigen stabilen Kohlenstoffisotops 13C erhalten (kommt in der Natur nur zu 1% vor), oder mit höherem Gehalt an schwerem Wasserstoff (Deuterium, sonst nur 0,015%).
|
| |
|
 |
| Natürlich muss man das so produzierte Protein erst noch von allen Verunreinigungen befreit werden. Dies geschieht durch Chromatographie auf solchen Trennsäulen. Protein und Verunreinigungen laufen dabei unterschiedlich schnell hindurch. Hier kann man an der (ausnahmsweise) blaßgelben Bande erkennen, wo sich das Protein gerade befindet. |
| Jetzt können unsere Messungen am NMR-Sprktrometer beginnen: |
| |
|
 |
|
|
| Das zu untersuchende Protein wird in einem geeigneten Lösungsmittel gelöst (meist Wasser mit definiertem pH-Wert, Salzgehalt etc.). Einige 100 µl der Lösung werden in ein NMR-Röhrchen aus Glas gefüllt. |
| |
|
 |
| Das Probenröhrchen wird mit Druckluft in eine Öffnung in der Mitte des Magneten eingelassen. Nach ausgiebigem Justieren können die NMR-Messungen beginnen. Ein NMR-Experiment kann zwischen 1h und 5 Tagen dauern. Für eine komplette Strukturaufklärung sind NMR-Messungen über viele Wochen erforderlich. |
 |
|
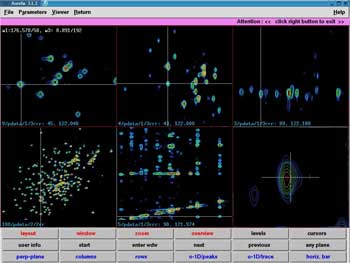
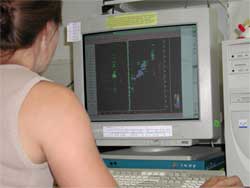
| Der zeitaufwendigste Schritt ist die Datenauswertung. Dabei helfen moderne graphische Bildschirmarbeitsplätze und computerisierte Auswertealgorithmen. |
| |
|
|
 |
|
| Trotzdem ist doch sehr oft der erfahrene Blick eines Spezialisten notwendig! |
 |
|
|
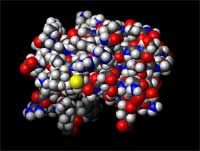
| Endlich ist es geschafft: spezielle Modeling-Programme berechnen aus den experimentellen NMR-Daten die Raumstrukturdes Proteins. |
| |
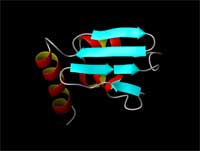 |
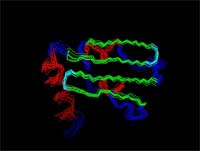
| Die grundlegenden Strukturelemente (Helix, Faltblatt) |
|
|
|
|
|
|
| Ein "Ensemble" zeigt die Genauigkeit der Struktur. |
| |
|
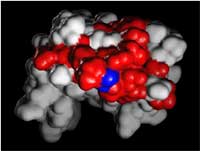 |
| Welche Bereiche sind an der Bindung einesanderen Proteins beteiligt? |














