Tools
| Worauf beruht unsere Meßmethode "NMR"? | ||||||||||||||
| NMR bedeutet im Englischen Nuclear Magnetic Resonance (kernmagnetische Resonanz). Viele Atomkerne verhalten sich wie kleine Stabmagnete, z.B. Kompaßnadeln. Solche magnetischen Atome sind z.B. Wasserstoff, Kohlenstoff, Stickstoff (die Hauptbestandteile von Proteinen) und viele mehr. Allerdings sind diese Magnete winzig klein und schwach. Für eine Kompaßnadel genügt das Erdmagnetfeld (0,00005 Tesla) zur Ausrichtung, wenn man sie ruhig hält und nicht zu sehr wackelt. Für unsere "Atomkern-Magnete" brauchen wir ein viel stärkeres Magnetfeld: ca. 10-20 Tesla, also mehrere hunderttausendfach stärker
|
||||||||||||||
 |
||||||||||||||
| Was ist ein "NMR-Spektrometer"? | ||||||||||||||
| Von außen: eine große Thermoskanne Von innen: vor allem ein (wirklich!) großer Elektromagnet, also eine Spule. In Garching steht eines der z.Zt. vier größten ("900 Mhz"-) NMR-Spektrometer der Welt. |
||||||||||||||
 |
||||||||||||||
| In dieser Spule fließt ein Strom von ca. 200 Ampere (!) und erzeugt so das starke Magnetfeld. Die ganze Spule wird tiefgekühlt (dafür die "Thermoskanne") auf ca. -270°C (!). Dazu wird die Thermoskanne mit flüssigem Helium gefüllt (das Gas, mit dem man Luftballons fällt, damit sie schweben). Bei dieser tiefen Temperatur verschwindet der elektrische Widerstand des Spulendrahtes: "Supraleitung", die 200A fließen viele Jahre lang immer weiter im Kreis, auch ohne Steckdose! (natürlich geht das nicht mit normalem Kupferdraht, es ist ein ganz spezielles, sehr sprödes, sehr kompliziertes und sehr teures Material aus Kupfer, Zinn, Titan, Niob und Tantal) |
||||||||||||||
| Was machen wir nun mit diesem Magnetfeld? | ||||||||||||||
| Wir bringen unsere Probe in's Magnetfeld. Dann drehen sich die Atomkerne wie Kompaßnadeln in Richtung des Feldes.
Interessant wird es nun, wenn wir unsere Atomkern-Magnete "stören". Bei Kompaßnadeln kann man die Nadel z.B. mit einem Spielzeugmagneten zur Seite drehen. Läßt man sie dann in Ruhe, so kann man beobachten, wie sie zurück in ihre Ruhelage (also nach Norden) schwingt. Die Atomkernmagnete "stören" wir mit einem Stromstoß auf eine kleine Drahtspule, die um die Probe gewickelt ist: das dadurch erzeugte Magnetfeld bringt die Kerne aus ihrer Ruhelage. Das Zurückkehren der Atomkernmagnete in ihre Ruhelage (in Richtung des Feldes unseres straken, supraleitenden Magneten) läßt sich einfach beobachten: eine Bewegung eines Magneten erzeugt ein elektromagnetisches Feld (Fahrraddynamo). Analog dazu erzeugt das Zurückschwingen unserer Atomkernmagnete einen (natürlich ganz schwachen!) Wechselstrom in unserer Darahtspule, den wir verstärken und messen können. |
||||||||||||||
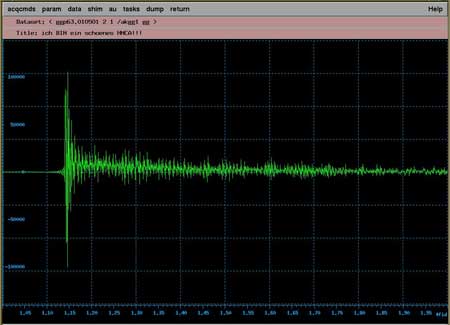 |
||||||||||||||
| unsere NMR-Signale! | ||||||||||||||
Dieses Phänomen heißt Resonanz, weil jeder Kern nach dem Anstoßen mit einer für ihn typischen Frequenz schwingt, so wie eine mit dem Klöppel angeschlagene Glocke. Allerdings "klingen" unsere Kerne nicht als Ton, sondern als Radiowelle im Bereich von ca. 100Mhz (UKW) bis 900Mhz (Handy D-Netz). |
||||||||||||||
| Und was fangen wir mit den NMR-Signalen an? | ||||||||||||||
Das Zurückschwingen der Atomkerne geschieht bei jedem Atom (in einem Molekül) mit etwasanderer Frequenz. So kann man sie nachher im Sprktrum unterscheiden: Im 1H-NMR-Spektrum von Ethanol erkennt man deutlich 3 Signale, die von den drei verschiedenen Arten von Wasserstoffatomen (H) im Molekül stammen. Die Signalintensitäten (rote Integrallinie = Fläche unter den Signalen) entsprechen dabei den Zahlenverhältnissen der drei Gruppen. |
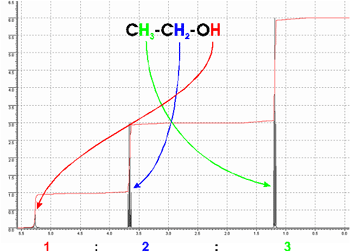 |
|||||||||||||
| So einfach ist Protein-NMR? | ||||||||||||||
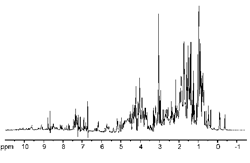 |
||||||||||||||
| Nicht ganz. In Ethanol gibt es nur drei Arten von H-Atomen und daher nur drei verschiedene NMR-Signale - sehr übersichtlich! In einem Protein mit ca. 150 Aminosäureresten gibt es aber über 1000 verschiedene H-Atome! und alle dieser über 1000 Signale liegen in einem engen Bereich (vielleicht doppelt so breit wie bei Ethanol): alles übereinander! |
||||||||||||||
| Was kann man da machen? | ||||||||||||||
|
|
||||||||||||||
| Â | 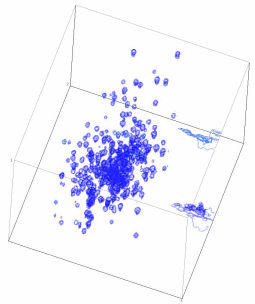 |
|||||||||||||
 |
||||||||||||||
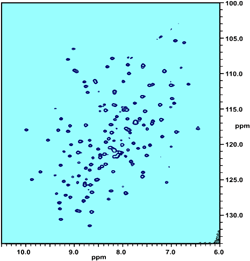
| Links: ein zweidimensionales NMR-Sprktrum eines Proteins, hier gibt es schon viel weniger Signalüberlagerungen! Rechts: dieser "Würfel" ist ein 3D-NMR-Spektrum, die einzelnen Signale haben nun noch mehr "Platz". | ||||||||||||||
| Wie kommt man nun zur Protein-Struktur? | ||||||||||||||
| In NMR-Spektren sind nicht nur einfach viele Signale zu sehen. Man erhält auch Informationen über die Anordnung der betreffenden Atome zueinander: ob sie durch chemiesche Bindungen miteinander verknüpft sind oder ob sie in enger räumlicher Nachbarschaft zueinander stehen.
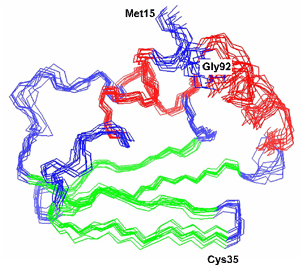
Hat man genügend viele dieser Informationen aus vielen verschiedenen Spektren zusammengetragen, dann kann man daraus die Raumstruktur eines Proteins ableiten (Nobelpreis für Chemie 2002 an Kurt Wüthrich!) |
||||||||||||||
 |
||||||||||||||
11 Proteinstrukturen berechnet aus den folgenden NMR-Daten:
(hinterlegt in der Proteindatenbank unter liba) |
||||||||||||||
