Results
Menschliches Tumor-Suppressorprotein p53
| In vielen menschlichen Tumoren ist das p53-Protein beschädigt oder verändert (mutiert).
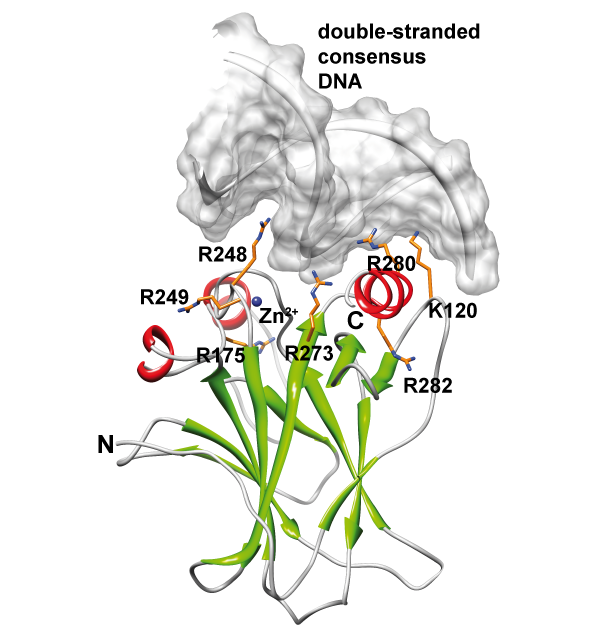
Man nimmt an, dass ein funktionsfähiges p53-Protein beschädigte DNA-Teile erkennen kann und verhindert, dass dadurch Krebs entsteht. p53 bindet nicht nur DNA, sondern eine Viezahl von Partner-Proteinen, wie die an den Mitochondrien lokalisierte BclxL oder Bcl2. Mit NMR konnte gezeigt werden, daß p53 an BclxL eine Konformationsänderung induziert, die für die weitere Signalleitung zur Induktion von Apoptose eine Rolle spielt. Relevante Publikationen:Hagn et al, J. Biol. Chem., 2010 Römer et al, Angew. Chem. Intl. Ed. 2006 Dehner et al, Angew. Chem. Intl. Ed. 2005 |
 |
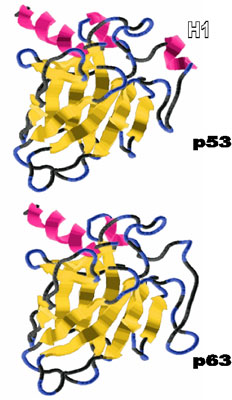
Menschliches p63-Protein
|
Das p63-Protein besitzt eine dem p53 (s.o.) so ähnliche Zusammensetzung, dass man davon ausgeht, dass es auch eine praktisch identische Struktur besitzt.
Über die biologische Funktion von p63 ist viel weniger bekannt, als bei p53. Es ist wahrscheinlich an der Regulation der Zellteilung beteiligt; möglicherweise spielt es ebenfalls eine Rolle bei der Tumorunterdrückung. Dieser kann mit den z.Zt. vorhandenen Modellen nicht erklärt werden (Abbildung), die ja auf der Ähnlichkeit von p53 und p63 beruhen. Mit NMR-Messungen wird nun die strukturelle Grundlage für diesen kleinen, aber wichtigen Unterschied gesucht, z.B. die genaue Lage und Länge der (roten) Helices (besonders von H1). |
|
Hsp90-Chaperon System aus Hefe
| Hsp90 ist ein sog. "Caperon", d.h. ein Protein, das bei der richtigen Faltung von bestimmten Proteinen in der Zelle hilft. Für seine Arbeit verbraucht es den "Zelltreibstoff" ATP, der an einer bestimmten Stelle gebunden und zu ADP umgewandelt wird. | |
 |
|
|
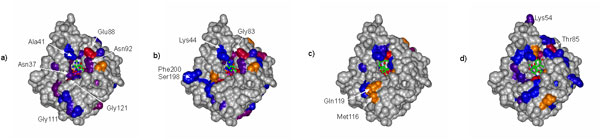
Mit NMR konnte die Bindungsstelle von "ATP" (bzw. einer stabilen Variante; a), ADP (b), Radicicol (c) und Geldanamycin (d) identifiziert werden. Radicicol und Geldanamycin sind natürliche Inhibitoren (d.h. Hemmstoffe) von Hsp90. Kleine Unterschiede in der Bindung helfen verstehen, wie diese Stoffe die Aktivität von Hsp90 beeinflussen können. Relevante Publikationen:Retzlaff, Hagn et al. Mol. Cell. 2010 Spicty, Taly, Hagn et al. Biophys. Chem. 2009 Richter, Moser, Hagn et al., J. Biol. Chem. 2006 Dehner et al, ChemBioChem, 2003 |